http://www.revista.ingenieria.uady.mx/volumen15/sensor.pdf
http://www.analesranf.com/index.php/mono/article/viewFile/1068/1065
http://www.acredit.ece.buap.mx/_DOCUMENT%20COMPROBAT%20DE%20AUTOEVALUAC/17_IA%2045%20C.8.1.2/Memorias%20FCE/fmcelect/P-FMC-003.pdf
http://www.saber.ula.ve/bitstream/123456789/23848/1/s_menolasina.pdf
Técnicas electroanalíticas
martes, 29 de mayo de 2012
sábado, 26 de mayo de 2012
Ejemplos
Ejemplo 1: Sensor de oxígeno (sensor de dos electrodos)
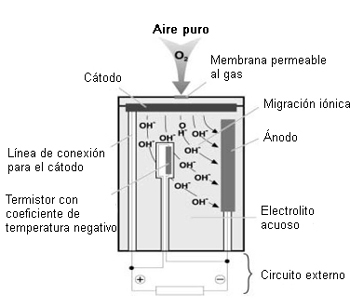
Los gases de combustión y las moléculas de oxígeno contenidas en ellos penetran a través de la membrana permeable al gas hasta el cátodo. Debido a su composición material, tiene lugar una reacción química en el cátodo con la formación de iones OH (los iones son partículas cargadas). Estos iones migran al ánodo a través del electrolito, creando un flujo de corriente proporcional a la concentración de O2. La caída de tensión desarrollada en una resistencia situada en el circuito sirve luego como señal de medición que se utiliza para el procesado electrónico posterior.
La resistencia incorporada con coeficiente de temperatura negativo (NTC), se usa para compensar los efectos de la temperatura, garantizando así que el sensor permanezca estable frente a los cambios de temperatura. La duración de un sensor de oxígeno de este tipo es de unos 3 años.
Ecuaciones de reacción del sensor de oxígeno:
En el cátodo: O2 + 2H2O + 4e- ------> 4OH-
En el ánodo: 2Pb + 4OH- ------> 2PbO + 2H2O + 4e-
Balance: 2Pb + O2 ------> 2PbO
Ejemplo 2: Sensores para CO, SO2 y NOx (sensor de tres electrodos)
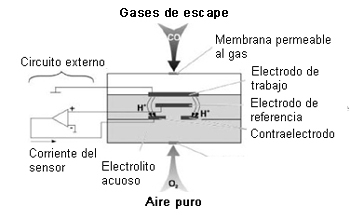
Para componentes del gas tales como CO, SO2 o NOx, se usan sensores con tres electrodos.
El funcionamiento se explica basándonos en un sensor de CO; cómo se aplica esto a los otros componentes se puede ver a partir de las ecuaciones de reacción.
Las moléculas de monóxido de carbono (CO) pasan, a través de la membrana permeable al gas, al electrodo de trabajo donde se forman iones H+ como consecuencia de una reacción química. Estos migran en el campo eléctrico al contraelectrodo, donde se genera un flujo de corriente en el circuito externo mediante otra reacción química desencadenada por el oxígeno (O2) del aire puro, también aportado. El tercer electrodo (electrodo de referencia) sirve para estabilizar la señal del sensor. La duración operativa de este tipo de sensor es de unos 2 años.
La duración de este tipo de sensor es alrededor de 2 años.
Ecuaciones de reacción para el CO
Ánodo: CO + H2O --------> CO2 + 2H+ + 2e-
Cátodo: 1/2 O2 + 2H+ + 2e- --------> H2O
Otras ecuaciones de reacción
SO2 + 2H2O ------> H2SO4 + 2H+ + 2e
NO + 2H2O ------> HNO3 + 3H+ + 3e-
NO2 + 2H+ + 2e- ----> NO + H2O
Sensor para CO y otros gases (esquema)
http://www.academiatesto.com.ar/cms/sensores-electroquimicos
Los gases de combustión y las moléculas de oxígeno contenidas en ellos penetran a través de la membrana permeable al gas hasta el cátodo. Debido a su composición material, tiene lugar una reacción química en el cátodo con la formación de iones OH (los iones son partículas cargadas). Estos iones migran al ánodo a través del electrolito, creando un flujo de corriente proporcional a la concentración de O2. La caída de tensión desarrollada en una resistencia situada en el circuito sirve luego como señal de medición que se utiliza para el procesado electrónico posterior.
La resistencia incorporada con coeficiente de temperatura negativo (NTC), se usa para compensar los efectos de la temperatura, garantizando así que el sensor permanezca estable frente a los cambios de temperatura. La duración de un sensor de oxígeno de este tipo es de unos 3 años.
Ecuaciones de reacción del sensor de oxígeno:
En el cátodo: O2 + 2H2O + 4e- ------> 4OH-
En el ánodo: 2Pb + 4OH- ------> 2PbO + 2H2O + 4e-
Balance: 2Pb + O2 ------> 2PbO

Ejemplo 2: Sensores para CO, SO2 y NOx (sensor de tres electrodos)
Para componentes del gas tales como CO, SO2 o NOx, se usan sensores con tres electrodos.
El funcionamiento se explica basándonos en un sensor de CO; cómo se aplica esto a los otros componentes se puede ver a partir de las ecuaciones de reacción.
Las moléculas de monóxido de carbono (CO) pasan, a través de la membrana permeable al gas, al electrodo de trabajo donde se forman iones H+ como consecuencia de una reacción química. Estos migran en el campo eléctrico al contraelectrodo, donde se genera un flujo de corriente en el circuito externo mediante otra reacción química desencadenada por el oxígeno (O2) del aire puro, también aportado. El tercer electrodo (electrodo de referencia) sirve para estabilizar la señal del sensor. La duración operativa de este tipo de sensor es de unos 2 años.
La duración de este tipo de sensor es alrededor de 2 años.
Ecuaciones de reacción para el CO
Ánodo: CO + H2O --------> CO2 + 2H+ + 2e-
Cátodo: 1/2 O2 + 2H+ + 2e- --------> H2O
Otras ecuaciones de reacción
SO2 + 2H2O ------> H2SO4 + 2H+ + 2e
NO + 2H2O ------> HNO3 + 3H+ + 3e-
NO2 + 2H+ + 2e- ----> NO + H2O
Sensor para CO y otros gases (esquema)

http://www.academiatesto.com.ar/cms/sensores-electroquimicos
Senseores electroquímicos
Una
definición clásica del sensor químico es: “pequeño dispositivo que,
como resultado de una interacción química entre un reactivo analítico y
un elemento sensor, transforma información química o bioquímica de
tipo cuali o cuantitativo en una señal medible y útil que se representa
en una pantalla o registro”. Cuando la determinación se hace a través de
un electrolito líquido se denomina al dispositivo Sensor Electroquímico [1].
Un sensor electroquímico
consiste en un electrodo sensor (cátodo, donde ocurren reacciones de
reducción, +) que puede ser de plomo (Pb), Plata (Ag). Oro (Au) o
Cadmio (Cd) y un contra electrodo (llamado el electrodo de trabajo,
electrodo de medición o ánodo ocurren reacciones de oxidación, signo -)
de Platino (Pt) separados por una delgada capa de material electrolito,
que generalmente es un gel de una sal inorgánica como el Cloruro de
Potasio (KCl, NaCl, AgCl) a una concentración 0,1 – 3,4 M, o perclorato
de litio (sensores de HCN). El gas tóxico que entra en contacto con el
sensor reacciona sobre la superficie del electrodo sensor generando una
reacción de oxidación o reducción. Los materiales del electrodo,
específicamente desarrollados para el gas de interés, catalizan estas
reacciones. Se genera un flujo o caudal de electrones que produce una
corriente proporcional a la concentración de gas, que puede ser medida
para determinar la concentración de gas. [2].


Existe
una membrana que separa el ambiente exterior del interior del sensor,
que esta inmerso en un líquido electrolito, la membrana funciona como
una barrera hidrófoba del tipo Zintex (para evitar el ingreso de agua) o
Teflón (PTFE), las moléculas del gas ingresan al sensor y se produce
una oxido-reducción, cerrando el circuito entre el ánodo y cátodo, los
electrones resultantes producidos se miden con un circuito electrónico,
la intensidad de la corriente es proporcional a la cantidad de gas que
ingresa a al sensor y en consecuencia con la concertación del gas en el
ambiente de trabajo. [3].
Ejemplo de detección de Monóxido de Carbono, CO:
Las reacciones de oxidación en el ánodo:
2CO + 2H2O 2CO2 + 4 H + + 4e –
Las reacciones de reducción en el cátodo:
O2 + 4 H ++ 4e– 2H2O
Reacción total en el Sensor:
2CO + O2 2CO2
En esta reacción se genera una corriente eléctrica de 4 e–
Los electrodos son de diferentes materiales
Características de los sensores electroquímicos más importantes y que debemos considerar al momento de seleccionar un sensor:
- Los sensores de celda electroquímica están diseñados para utilizarse como monitores de gases tóxicos.
- Estos sensores sólo son adecuados para rangos de muy baja concentración (ppm, ppb y hasta ppt).
- Para aplicaciones portátiles, el sensor electroquímico tiene muchas ventajas:
- Tiene muy bajo consumo de energía.
- Responde rápidamente a un gas específico.
- No se ve afectado por la humedad.
- Los sensores sólo están expuestos a gas periódicamente, lo que maximiza la vida del sensor.
- La esperanza de vida es de dos años; sin embargo, dependiendo de del uso y ambiente de trabajo, puede ser mucho más corto.
Hay
aproximadamente 20 gases tóxicos que pueden medirse en ppm mediante
sensores electroquímicos entre ellos: NH3, CO, CL2 , H2 , HCL, HCN, H2S,
NO, NO2 , O2 , O3 y SO2. Para el resto de los gases (para rangos de
ppm) se usan sensores de estado sólidos o de Fotoionización (PID) [4].
Los
equipos de monitoreo de gases tóxicos de las diferentes marcas
disponibles en el mercado tiene como base el funcionamiento de varios
sensores de gases instalados en el equipo (frecuentemente hasta 6),
debemos aclarar que los fabricantes de los sensores no son los mismos
“fabricantes” de los equipos de medición, por ejemplo en el mercado
conocemos marcas como MSA, RAE, Speridan, Scott, Draeger etc y algunos
usan sensores de marcas como Synkera, Dart Sensors Ltd,, ATS AGRO,
FLOWMEET ARGENTINA, Membrapor, Electrochemical Sensor Technology (EST)
Ltd. y muchísimos más ; esto nos debe permitir hacer una selección más
apropiada de equipos de medición con sensores que se adapten a nuestras
condiciones de trabajo y lograr mas exactitud y precisión, mas duración y
menos necesidad de calibraciones externas.
Existen
equipos que son muy resistentes, pero a lo mejor la calidad de las
mediciones con los sensores que traen de fábrica presenta algunas
desviaciones en función de las características de cada sensor.
Suscribirse a:
Comentarios (Atom)